Microscopie électronique
Le Service de Microscopie Électronique (SME) de l’Institut de Biologie Paris-Seine offre à la communauté scientifique (IBPS, Sorbonne Université, organismes publics et privés) un ensemble de compétences et d’équipements en microscopie électronique en transmission et à balayage (MET, MEB). Le SME est animé par une équipe de trois ingénieurs qui assurent l’accompagnement méthodologique, la formation des utilisateurs, la maintenance des équipements et l’animation scientifique (séminaires, enseignement).
Nos compétences
Le SME donne accès à un grand
parc d’équipements adapté à l'observation et à la préparation en MET et en MEB d'échantillons variés : cellules
et organismes, macromolécules, cosmétiques, pharmaceutiques, agro-alimentaire,
etc. La préparation d’échantillons, pour les études ultrastructurales, d’immunolocalisations, ou en 3D, peut être assurée « conventionnellement »,
par méthode chimique, ou en utilisant les cryotechniques pour lesquelles le SME
a une longue expérience (cryofixation haute-pression, cryosubstitution, plonge
dans l’éthane liquide, cryofracture, cryodécapage, cryo-MEB).
Méthodologies
- Préparation d’échantillons et observation conventionnelle en MET (cytochimie ultrastructurale, immunocytochimie, ultramicrotomie, contraste négatif)
- Cryofixation haute-pression ou par plonge dans l'éthane, cryosubstitution
- Préparation d’échantillons et observation haute résolution en MEB conventionnelle, en cryo-MEB (cryofracture, cryodécapage) et en STEM-in-SEM
- Microscopie corrélative (CLEM)
- Imagerie 3D « volumique » par array tomography
Prestations
Tous les projets développés au sein de la plateforme incluent une assistance à la conception, au suivi ou à la réalisation et une analyse des résultats. Un entretien précède chaque projet pour évaluer la faisabilité et proposer les techniques les plus appropriées.
- Préparation d’échantillons (température ambiante et cryo) en MET et en MEB
- Formation à la préparation d’échantillon et à l’observation
- Séances d'observation autonomes
- Séances d'observation assistées d'un personnel de la plate-forme
- Projets collaboratifs personnalisés à long terme
Equipements
Notre parc d'équipements est doté des équipements de préparation, d’un
Microscope Electronique à Balayage (MEB) haute résolution pour visualiser la surface des
échantillons et d'un Microscope Electronique en Transmission (MET), pour
observer des coupes conventionnelles d'échantillons (80 – 120
kV), ou atteindre les échelles moléculaires (200 kV) :
- Microscope Électronique en Transmission LaB6 80-200kV
(2100HC, JEOL) + caméra grand-angle.
- Microscope Électronique à Balayage haute résolution à Emission de champ (GeminiSEM 500, Zeiss) à température ambiante et cryo (VCT100, Leica)
- Vibratome (VT1000S, Leica)
- Ultramicrotomes (UCT, Leica)
- Station de cryofixation par plonge dans l’éthane
liquide (CPC, Leica)
- Cryofixateur haute-pression (HPM100, Leica)
- Enceinte de cryosubstitution (AFS, Leica)
- Contournement du point critique (CPD300, Leica)
- Métalliseur par pulvérisation cathodique et e-beam
(ACE600, Leica)
- Logiciels de reconstruction tomographique (Imod, TomoJ) et d'acquisition en array tomography (Atlas 5, Fibics)
Développements méthodologiques
Le service s’investit
dans différents développements technologiques pour offrir des solutions
méthodologiques innovantes adaptées à chaque problématique, par exemple :
préservation optimale des échantillons (cryométhodes), reconstruction 3D
(array tomography) ou recherche d’évènements rares repérés en
fluorescence (microscopie corrélative).
Ainsi, nous nous sommes équipés dès janvier 2016
d’un MEB haute
résolution (Zeiss GeminiSEM 500) couplé à une platine de cryo-observation (Leica VCT100) et à une
interface pour
imager automatiquement des coupes sériées en Array tomography (Zeiss Atlas 5 AT).
Cet équipement, premier en France en biologie,
permet
d’observer des cellules et tissus à l’état natif et en haute
résolution aux
niveaux subcellulaire et moléculaire, et de générer des images de
type MET avec
un contraste élevé et de très grands champs d’observation ou de
grands volumes (reconstruction
3D).
Actualités de la plate-forme
Le collagène comme vous ne l’avez jamais vu !
Une étude montrant la production in vitro de membranes de collagène pour le développement de biomatériaux vient d'être publiée. Cette étude, conduite par Carole Aimé, a été réalisée par les équipes Matériaux et biologie et Reactive Materials for Electrochemical deviceS du Laboratoire de Chimie de la Matière Condensée de Paris (UMR 7574), spécialisées dans l’ingénierie de biomatériaux.
Le SME a contribué aux analyses multi-modales et multi-échelles de cette étude. Nous avons réalisé une approche d’imagerie rare et originale en « cryo-MEB directe ». L’échantillon a été visualisé à l’échelle nanoscopique dans un état hydraté et quasi natif.
L’échantillon a uniquement été figé à très basse température (cryo-fixation) avant d’être observé. Cette méthode a ainsi préservé l’organisation et la structure fine des fibrilles de collagène, fortement altérées avec les méthodes de préparation conventionnelles en MEB, qui requièrent une préparation chimique (fixation, déshydratation, séchage et dépôt de surface).
L’article, dans lequel les personnels du SME sont remerciés, est téléchargeable ici :
https://pubs.acs.org/doi/abs/10.1021/acsabm.0c00006
Un MEB haute-résolution pour explorer l’ultrastructure des tissus dans les 3 dimensions
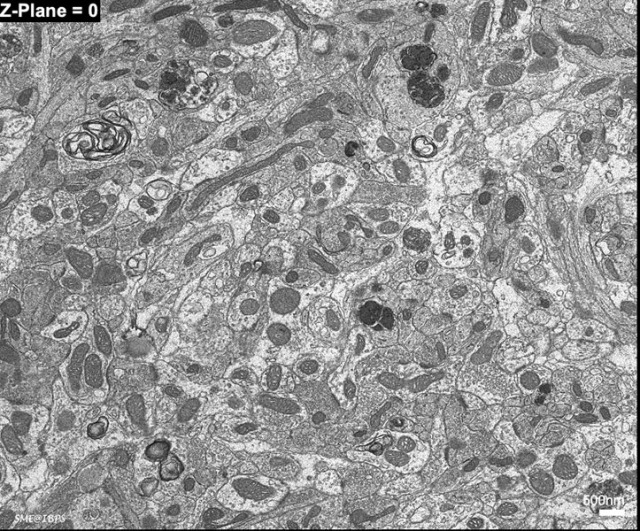
Dans cette vidéo d'exemple de tissu nerveux (collaboration équipe Développement et Plasticité des Réseaux Neuronaux, UMR 8246 Neurosciences), des portions de couches neuronales olfactives de souris ont été explorées avec la méthode d’array tomography.
L’array tomography exploite les performances du Microscope Electronique à Balayage (MEB) haute-résolution de la plate-forme. Doté d'une optique et de détecteurs de nouvelle génération, associés à un puissant logiciel d'automatisation (Atlas 5 Zeiss), ce microscope est capable de produire des «images de type MET» à partir d’échantillons biologiques préparés conventionnellement (fixation, inclusion, ultramicrotomie et contraste).
Les images obtenues ont une résolution latérale nanométrique (ici 2,5nm/pixel) et une résolution axiale offerte par l’épaisseur des différentes sections ultrafines récupérées (ici 80 nm).
Grace à l’array tomography, et aux performances de notre MEB, il est maintenant possible d’acquérir :
- des champs d’observations millimétriques, à l’aide d’une mosaïque d’acquisitions de régions contiguës
- des volumes d’échantillons couvrant une profondeur de dizaines de micromètres, en acquérant les régions d’intérêt répétées sur des dizaines/centaines de sections successives







